‘반도체’라고 하면 복잡하고 어렵게만 느껴지지는 않나요? 하지만 대부분 반도체는 일상에서 흔히 볼 수 있는 물질인 ‘실리콘(규소, Silicon, Si)’으로 만듭니다. 접착 고무, 성형 수술 보형물 등으로도 실리콘을 사용하는데요. 실리콘이 어떻게 반도체 원재료가 될 수 있었는지 영하이라이터와 함께 무궁무진한 원소, 실리콘을 알아보겠습니다.
흰 도화지 같은 원소 실리콘

▲ 실리콘(규소, Silicon, Si)
반도체 원료인 실리콘은 지구 지각(地殼)에서 산소 다음으로 풍부한 원소로 전체 지각 질량의 약 27.7%를 차지합니다. 우리 주위에서 보이는 흙, 모래, 돌멩이는 이산화규소(SiO2)로 이뤄지는데, 이 물질을 구성하는 원소가 바로 실리콘입니다.
실리콘은 자원이 풍부해 가격이 저렴하고, 독성이 없어 환경이나 인체에도 무해하죠. 또한, 전기 전도율을 높이려고 불순물 원자를 첨가하는 도핑(Doping)을 통해 전기전도나 전도 형태를 변형 할 수 있는데요. 이처럼 흰 도화지 같은 원소여서 반도체 주원료로 사용합니다.
하지만 처음부터 반도체 주 원료가 실리콘은 아니었습니다. 트랜지스터에서 출발한 초창기에는 게르마늄(Ge)을 주로 사용했는데요. 실리콘이 게르마늄 보다 순도, 결정 구조에서 우수하고, 고온에서 안정한 산화막을 형성하는 등의 장점이 있어 현재 반도체 소자 90% 이상은 실리콘 웨이퍼를 원료로 만들고 있습니다. 미국 캘리포니아 주에 있는 실리콘 밸리(Silicon Valley) 명칭도 실리콘에서 유래했을 정도로 반도체 산업에 중요한 요소인데요. 반도체는 전기가 잘 통하는 도체와 통하지 않는 절연체 중간 정도의 전기 저항이 있는 물질입니다. 얼마나 도핑하는 하느냐에 따라 전도도를 조절할 수 있죠. 특히 금속과 달리 온도를 올리면 저항이 줄어들어 전기 전도도가 높아지는 점이 반도체의 중요한 특성인데요. 실리콘의 어떠한 성격 때문에 이런 특성을 띄는 것일지 지금부터 살펴보겠습니다.
반도체 성질을 구현하는 실리콘
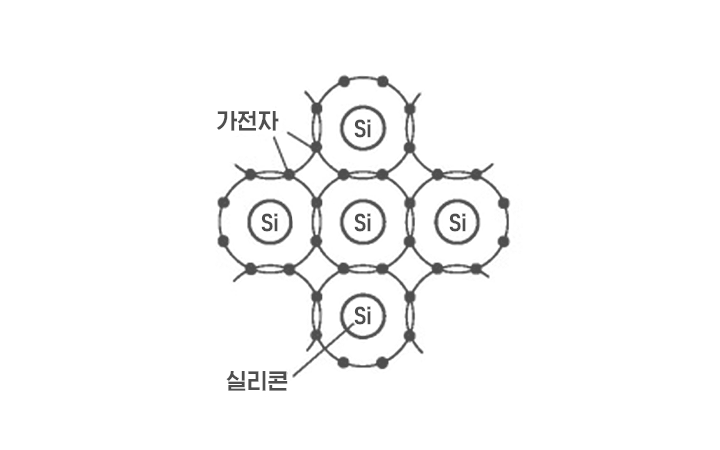
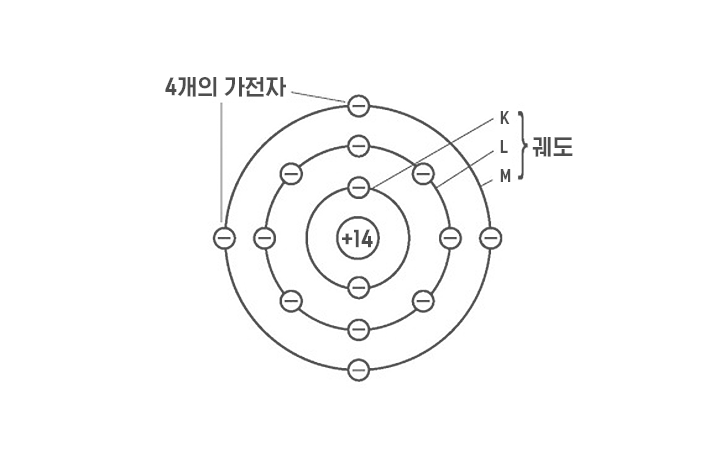
실리콘은 주기율표상 4주기 14족에 있습니다. 주기율표는 물질을 이루는 기본 성분인 원소를 양의 전하를 지니고 중성자와 더불어 원자핵을 구성하는 입자인 양성자 수에 따라 배열한 표를 말하는데요. 14족 원소는 공통적으로 원소 가장 바깥 껍질에서 전자로 화학 반응에 참여할 수 있는 전자인 최외각전자 4개를 가집니다. 안정한 상태를 만들기 위해 실리콘은 이웃 원자 4개와 전자를 공유해 공유결합을 형성합니다.
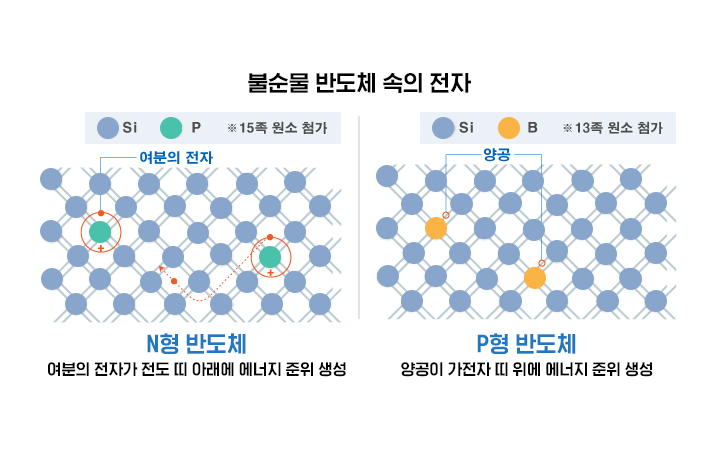
▲ 반도체 도핑
반도체 공정에서 도핑에 사용되는 불순물에 따라 반도체를 N형 반도체(N-type semiconductor)와 P형 반도체(P-type semiconductor)로 나뉩니다. 최외각전자가 4개인 실리콘에 인(P), 바소(As)와 같이 최외각전자가 5개인 15족 원소를 주입하면, 5개 전자 중 4개는 이웃하는 실리콘 원자들과 공유되고, 나머지 1개의 전자는 결합을 이탈해 결정 안을 자유롭게 움직이는 전도 전자가 됩니다. 전도 전자는 음(Negative, N) 전하량을 운반하므로 다수의 이동성 전자와 소수의 정공을 포함하는 반도체가 되는데 이를 N형 반도체라고 합니다. 정공은 가전자가 업거나 빠진 자리의 원자 최웨각 궤도인데요. 반대로 붕소(B), 알루미늄(Al)과 같은 13족 원소를 주입하면 정공이 생성되는데, 정공은 양 전하량(Positive, P)를 운반하기 때문에 다수의 정공, 소수의 이동성 전자를 포함하는 P형 반도체가 됩니다
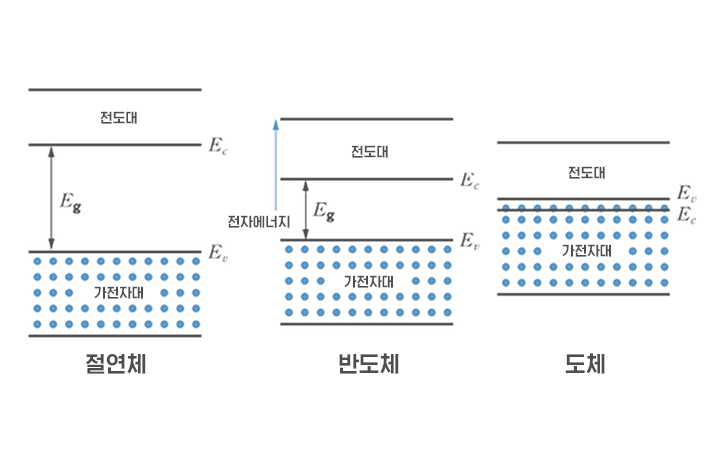
▲ 절연체, 반도체, 도체의 각 에너지 밴드 갭
물질을 구성하는 기본 입자인 원자 내부 전자는 불연속적인 에너지 준위가 있습니다. 하지만 멀리 있던 원자들이 결정 구조를 형성하면서 서로 가까워지면, 불연속적인 에너지 준위들이 상호작용해 띠 형태의 에너지 밴드(Energy Band)를 형성합니다.
갭으로 나눠 밴드 중 낮은 에너지의 밴드를 가전자대(Valence Band)라고 하고, 높은 에너지의 밴드를 전도대(Conduction Band)라고 합니다. 이 두 밴드의 에너지 차이를 에너지 갭(Energy gap, Eg) 혹은 밴드 갭(Band Gap)이라고 하는데, 이는 각 물질마다 고유한 값이 있습니다. 에너지를 얻어 흥분된 전자가 작은 전자가 자유롭게 움직일 수 있는 에너지대인 전도대로 이동해야 전류를 흐르게 하기 때문에 밴드 갭 크기는 매우 중요합니다.
밴드갭은 절연체의 경우 크기가 커서 전도에 참여하는 자유전자 생성이 어렵고, 반도체의 경우는 중간 정도여서 적절한 에너지를 가하면 전자가 전도대로 전이돼 전도에 참여할 수 있습니다. 또한, 도체일 경우 밴드가 겹쳐서 나타나거나 부분적으로 차 있어 전자가 자유롭게 움직입니다. 특히 반도체는 사용자가 원할 때 전기를 흘려 보낼 수 있어야 해서 적절한 밴드갭을 가지는 것은 중요한데요. 실리콘은 1.1 eV 상당의 적절한 밴드갭을 가져 반도체의 주재료로 사용되고 있습니다.
실리콘 한계를 넘는 실리센 & 실리콘 카바이드
50년의 긴 시간 동안 실리콘이 반도체의 주원료로 사용돼 왔지만, 이는 미세공정에서 한계를 보입니다. 최근 실리콘을 기반으로 하되 이 한계를 극복한 소재에 관한 연구가 활발히 일어나고 있는데요. 이러한 대표적인 신소재로는 실리콘의 2차원 구조인 실리센(Silicene), 실리콘과 탄소의 화합물인 실리콘 카바이드(Silicon Carbide, SiC)가 있습니다.

▲ 실리센 육각형 벌집 모양 구조 (출처 : <네이쳐> 트위터)
실리센이란 실리콘 원자가 육각형 벌집 모양으로 배열된 2차원 물질로 반도체 특성이 있습니다. 탄소 원자 한 개 두께의 매우 얇은 2차원 구조로, 탄소 원자들이 육각형 벌집 모양으로 배열된 그래핀(Graphene)을 본 따 만들어졌는데요. 그래핀은 열, 전기 전도도가 높고 전자 이동 속도가 높으면서도 강도가 매우 강합니다. 또한, 탄성이 뛰어나 늘리거나 구부려도 전기적 성질을 유지해 ‘꿈의 나노물질’이라고 부르죠. 하지만 밴드갭이 없어 반도체로 바로 활용하지 못하는 단점이 있습니다. 그래서 적절한 밴드갭이 있는 실리콘을 그래핀처럼 2차원 벌집 모양의 구조로 배열해본 결과, 실리센은 그래핀의 높은 열, 전기 전도성, 강도성, 유연성을 가졌음을 확인할 수 있었습니다. 전자기기가 점차 소형화를 이루면서 반도체 부품들도 작아지고 있고 최근 플렉서블 디스플레이와 같이 휘어지는 전자기기에 대한 수요가 증가했기 때문에 실리센 활용이 더욱 기대됩니다.
![]()
▲ 실리콘 카바이드
또 다른 신소재는 실리콘 카바이드(Silicon Carbide, SiC)입니다. 실리카(SiO2)와 코크스(C)를 전기로에서 2,300도가량의 높은 온도로 가열해 제조하는 인공 화합물입니다. 한국 말로는 탄화규소라고도 부르는데요. 비교적 손쉽게 얻을 수 있는 실리콘 대신 높은 열을 가해 합성해야 하지만 그럼에도 실리콘 카바이드를 사용하는 이유가 있는데요. 실리콘 카바이드의 밴드갭은 3.26 eV 정도로 1.12 eV 정도의 밴드갭을 가지는 실리콘보다 3배나 밴드갭이 넓고, 전자 포화 속도가 2배가 높고, 열전도성은 3배가 높습니다. 또한, 절연 파괴전압이 10배나 높아 높은 전압을 걸어줘도 반도체가 잘 작동하게 합니다. 이러한 실리콘 카바이드의 물성은 고온, 고전압, 고 전류 상태에서 높은 안정성을 보여주기 때문에 전자 제품을 최소한의 전력으로 구동시키는 전력반도체에 사용됩니다. 이뿐만 아니라 모스 경도 9.15 정도로 다이아몬드 못지 않은 강도지만, 이보다 저렴해 여러 산업에 전반적으로 사용하고 있습니다.
지금까지 반도체를 구성하는 원재료, 실리콘을 낱낱이 파헤쳐보았습니다. 실리콘은 공정을 통해 원하는 용도로 성질을 쉽게 변화시킬 수 있다는 점이 인상깊었는데요. 모래에서 얻어지는 실리콘이 반도체가 들어가는 전자제품을 만드는데 쓰인다는 사실이 놀랍지 않나요? 반도체 안에는 과학적 지식뿐만 아니라 태초 자연의 모습도 담겨 있었습니다. 알면 알수록 신기하고 새로운 반도체의 세계, 어렵다고 멀리하지 말고 차근차근 함께 알아보아요.